シロイヌナズナのゲノム編集について:概要、変異アリルの検出・同定
提供: 鈴木研Wiki
(版間での差分)
細 (→[3] 変異型アリルの検出(遺伝子型の同定:genotyping)) |
(→<CRISPR-Cas9によるゲノム編集の概要>) |
||
| (2人の利用者による、間の17版が非表示) | |||
| 1行: | 1行: | ||
__notoc__ | __notoc__ | ||
| − | ==[1] | + | ==[1](概要)CRISPR-Cas9によるゲノム編集での変異体の作製== |
| − | * 以下の説明は、pKIベクターの解説サイトの図に一部加筆したもの https://www.jst.go.jp/pr/announce/20161117-2/index. | + | <table><tr><td> |
| + | ====<CRISPR-Cas9によるゲノム編集の概要>==== | ||
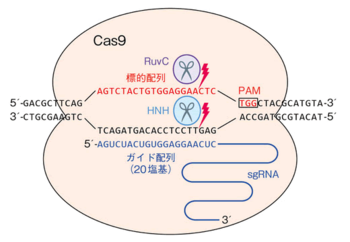
| + | * ゲノム編集によって変異を入れたい箇所の「'''標的配列を含むガイドRNA''' ('''sgRNA''': single guide RNA)」と「DNA切断酵素 '''Cas9'''」の2つを発現させるプラスミドを作製し、形質転換によって植物に導入する | ||
| + | :* 標的配列は、「'''PAM配列:NGG'''」の上流側に隣接する約20塩基の配列 | ||
| + | * 形質転換された植物では、"ゲノムDNA中の標的配列の反対鎖" と "sgRNA" が相補的塩基対を形成。そこで、「PAM配列:NGG」の上流3-4塩基間でゲノムDNAを切断する('''DNA二本鎖切断''') | ||
| + | ::* 右の図を参照。 (この図は、「ゲノム編集産業化ネットワーク」のサイトより引用) <BR> | ||
| + | ::::: https://www.mls.sci.hiroshima-u.ac.jp/smg/GEIN/map/crispr-cas9/index.html | ||
| + | * 切断されたDNAを修復する際に、'''塩基の「挿入・欠失 (indel)」'''が生じてDNA配列が改変されることで、変異型アリルができる | ||
| + | :* 塩基の「挿入・欠失 (indel)」による変異型アリルについては、下記の'''「[3] 変異型アリルの検出」'''を参照 | ||
| + | </td> | ||
| + | <td> | ||
| + | [[File:CRISPR-Cas9.png|350px]] | ||
| + | </td> | ||
| + | </tr> | ||
| + | </table> | ||
| + | |||
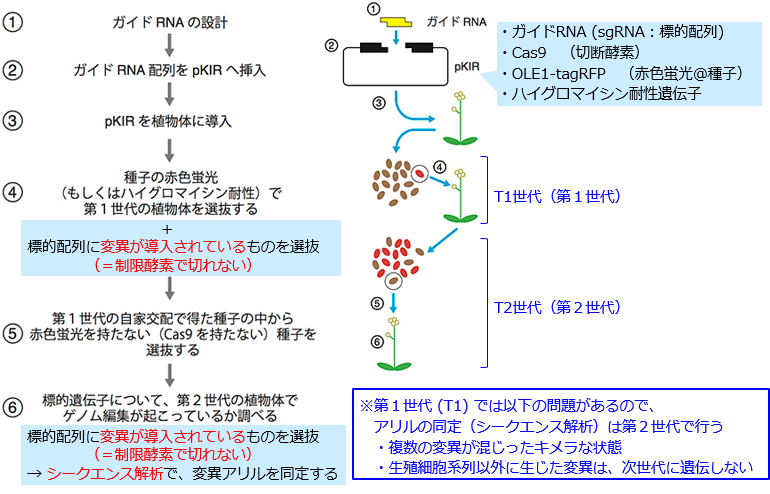
| + | ====<ゲノム編集による変異体の作製手順:pKIベクターを用いた場合>==== | ||
| + | 以下の説明は、pKIベクターの解説サイトの図に一部加筆したもの https://www.jst.go.jp/pr/announce/20161117-2/index.html <BR> | ||
:::(※ ガイドRNAの設計方法については、別記参照) | :::(※ ガイドRNAの設計方法については、別記参照) | ||
| 7行: | 24行: | ||
==[2] ゲノム編集によってできる変異型のアリルについて== | ==[2] ゲノム編集によってできる変異型のアリルについて== | ||
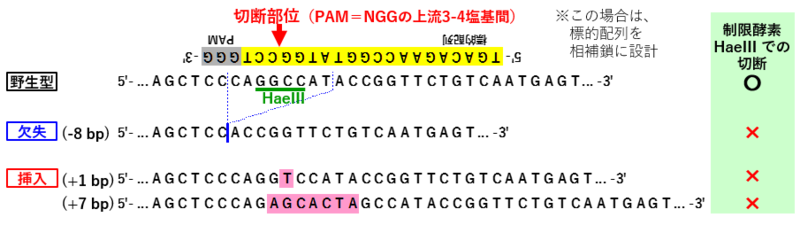
| − | * CRISPR- | + | * CRISPR-Cas9によるゲノム編集では、'''PAM配列(NGG)の上流3-4塩基間が切断'''される |
* その切断個所を修復する際に、「挿入・欠失 (indel)」が生じて、フレームシフト等の変異型アリルができる | * その切断個所を修復する際に、「挿入・欠失 (indel)」が生じて、フレームシフト等の変異型アリルができる | ||
| − | + | :* 以下は、ゲノム編集での変異アリルの例 | |
:[[File:ゲノム編集での変異アリルの例.png|800px]] | :[[File:ゲノム編集での変異アリルの例.png|800px]] | ||
::* 挿入・欠失 (indel) は上記の例のように、数bpの場合もあれば、数十bp~100bp以上の場合もある | ::* 挿入・欠失 (indel) は上記の例のように、数bpの場合もあれば、数十bp~100bp以上の場合もある | ||
| 16行: | 33行: | ||
==[3] 変異型アリルの検出(遺伝子型の同定:genotyping)== | ==[3] 変異型アリルの検出(遺伝子型の同定:genotyping)== | ||
<table><tr><td> | <table><tr><td> | ||
| − | * | + | * ゲノム編集による変異の有無を検出できるように、ゲノム編集による切断部位と制限酵素サイトが重なるように標的配列を決めて、sgRNAを設計 |
::※ 変異が生じると制限酵素サイトが無くなるので、「制限酵素で切れる」「切れない」の違いで、変異体の判別が可能になる | ::※ 変異が生じると制限酵素サイトが無くなるので、「制限酵素で切れる」「切れない」の違いで、変異体の判別が可能になる | ||
| − | + | * sgRNAの配列と検出に用いた制限酵素の例、については上記 '''[2] ゲノム編集によってできる変異型のアリルについて''' の図を参照 | |
| − | * sgRNAの配列と検出に用いた制限酵素の例、については上記[2]の図を参照 | + | |
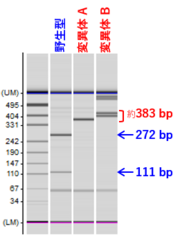
:* この例では、ゲノム編集した箇所をはさんだ領域をPCRで増幅した断片 (383bp) をHaeIII処理すると、以下の長さの断片になる | :* この例では、ゲノム編集した箇所をはさんだ領域をPCRで増幅した断片 (383bp) をHaeIII処理すると、以下の長さの断片になる | ||
::::(右図の電気泳動パターンを参照) | ::::(右図の電気泳動パターンを参照) | ||
| 36行: | 52行: | ||
==[4] 変異型アリルの同定(ゲノム編集した植物のシークエンス解析)== | ==[4] 変異型アリルの同定(ゲノム編集した植物のシークエンス解析)== | ||
'''(1) キャピラリーシークエンスを行う''' | '''(1) キャピラリーシークエンスを行う''' | ||
| − | + | * '''[3]変異型アリルの検出''' で用いたPCR産物(制限酵素処理"前"のもの)を用いて、シークエンス解析を行う | |
| − | + | * キャピラリーシークエンスの方法は、「[[BigDye Terminaterを使ったシークエンス]]」を参照 | |
| − | + | ::* シークエンス反応時に使うプライマーは、[3]のPCRで使用した両側のプライマー | |
| − | :::: | + | ::::=PCR産物1個につき、シークエンスは2サンプル、となる (両側のプライマー=センス、アンチセンスの2種類で読むため) |
| − | + | ::* 1反応 (計10ul) あたりに、PCR産物を "1ul" 使用する | |
| − | + | :::(プライマーダイマーがある場合は、精製・定量したうえで、プロトコール通りの量を使用 (精製方法:[[NucleoSpin Gel and PCR Clean-upを使ったDNA精製]]) | |
'''(2) 解析に使うデータ(ファイル)を準備する''' | '''(2) 解析に使うデータ(ファイル)を準備する''' | ||
| − | + | * キャピラリーシークエンサーで読んだ波形ファイル(拡張子.ab1) ※上記'''(1)'''で得られたデータ | |
| − | + | * ゲノム編集した「遺伝子のもとの配列」の情報(sgRNA配列の位置がわかるもの) | |
'''(3) シークエンスデータを解読して配列を決定し、アリルを同定する''' | '''(3) シークエンスデータを解読して配列を決定し、アリルを同定する''' | ||
| − | + | * シークエンスデータの解読方法については、別記「[[ゲノム編集した植物のシークエンスの解析]]」を参照 | |
<BR><BR> | <BR><BR> | ||
2021年11月30日 (火) 10:39時点における最新版
[編集] [1](概要)CRISPR-Cas9によるゲノム編集での変異体の作製
[編集] <CRISPR-Cas9によるゲノム編集の概要>
|
[編集] <ゲノム編集による変異体の作製手順:pKIベクターを用いた場合>
以下の説明は、pKIベクターの解説サイトの図に一部加筆したもの https://www.jst.go.jp/pr/announce/20161117-2/index.html
- (※ ガイドRNAの設計方法については、別記参照)
[編集] [2] ゲノム編集によってできる変異型のアリルについて
- CRISPR-Cas9によるゲノム編集では、PAM配列(NGG)の上流3-4塩基間が切断される
- その切断個所を修復する際に、「挿入・欠失 (indel)」が生じて、フレームシフト等の変異型アリルができる
[編集] [3] 変異型アリルの検出(遺伝子型の同定:genotyping)
|
[編集] [4] 変異型アリルの同定(ゲノム編集した植物のシークエンス解析)
(1) キャピラリーシークエンスを行う
- [3]変異型アリルの検出 で用いたPCR産物(制限酵素処理"前"のもの)を用いて、シークエンス解析を行う
- キャピラリーシークエンスの方法は、「BigDye Terminaterを使ったシークエンス」を参照
- シークエンス反応時に使うプライマーは、[3]のPCRで使用した両側のプライマー
- =PCR産物1個につき、シークエンスは2サンプル、となる (両側のプライマー=センス、アンチセンスの2種類で読むため)
- 1反応 (計10ul) あたりに、PCR産物を "1ul" 使用する
- (プライマーダイマーがある場合は、精製・定量したうえで、プロトコール通りの量を使用 (精製方法:NucleoSpin Gel and PCR Clean-upを使ったDNA精製)
(2) 解析に使うデータ(ファイル)を準備する
- キャピラリーシークエンサーで読んだ波形ファイル(拡張子.ab1) ※上記(1)で得られたデータ
- ゲノム編集した「遺伝子のもとの配列」の情報(sgRNA配列の位置がわかるもの)
(3) シークエンスデータを解読して配列を決定し、アリルを同定する
- シークエンスデータの解読方法については、別記「ゲノム編集した植物のシークエンスの解析」を参照