シロイヌナズナのゲノム編集について:概要、変異アリルの検出・同定
提供: 鈴木研Wiki
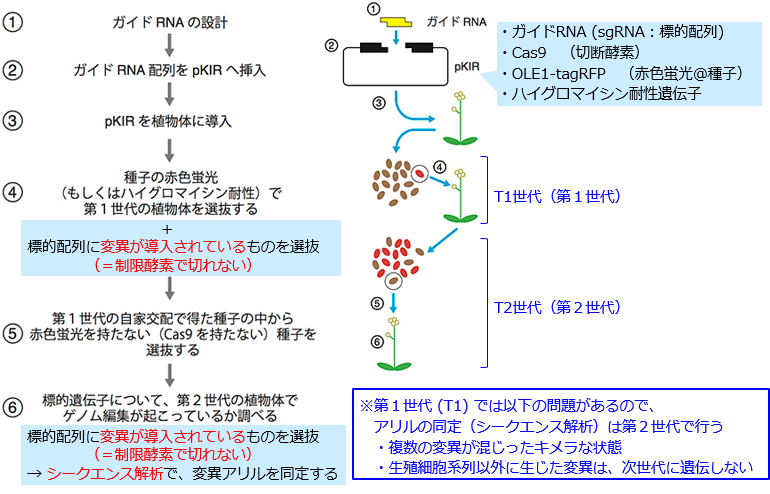
[1](概要)ゲノム編集で変異体を作成する手順:pKIベクターを用いた場合
- 以下の説明は、pKIベクターの解説サイトの図に一部加筆したもの https://www.jst.go.jp/pr/announce/20161117-2/index.html
- (※ ガイドRNAの設計方法については、別記参照)
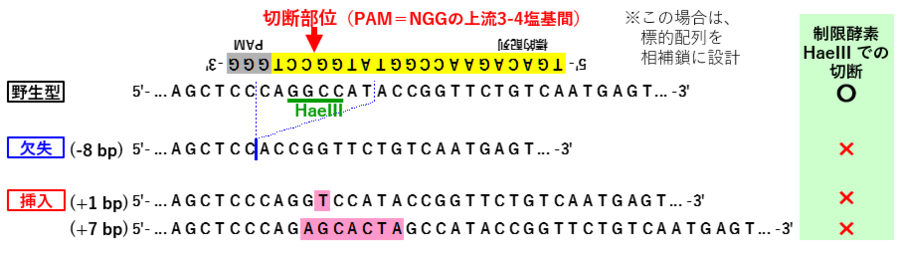
[2] ゲノム編集によってできる変異型のアリルについて
- CRISPR-Cas9によるゲノム編集では、PAM配列(NGG)の3塩基手前が切断される
- その切断個所を修復する際に、「挿入・欠失 (indel)」が生じて、フレームシフト等の変異型アリルができる
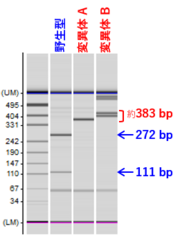
[3] 変異型アリルの検出(遺伝子型の同定:genotyping)
|
[4] 変異型アリルの同定(ゲノム編集した植物のシークエンス解析)
(1) キャピラリーシークエンスを行う
- [3]で用いたPCR産物(制限酵素処理"前"のもの)を用いて、シークエンス解析を行う
- キャピラリーシークエンスの方法は、「BigDye Terminaterを使ったシークエンス」を参照
- シークエンス反応時に使うプライマーは、[3]のPCRで使用した両側のプライマー
- =PCR産物1個につき、シークエンスは2サンプル、となる (両側のプライマー=センス、アンチセンスの2種類で読むため
- 1反応 (計10ul) あたりに、PCR産物を "1ul" 使用する
- (プライマーダイマーがある場合は、精製・定量したうえで、プロトコール通りの量を使用 (精製方法:NucleoSpin Gel and PCR Clean-upを使ったDNA精製)
(2) 解析に使うデータ(ファイル)を準備する
- キャピラリーシークエンサーで読んだ波形ファイル(拡張子.ab1) ※上記(1)で得られたデータ
- ゲノム編集した「遺伝子のもとの配列」の情報(sgRNA配列の位置がわかるもの)
(3) シークエンスデータを解読して配列を決定し、アリルを同定する
- シークエンスデータの解読方法については、別記「ゲノム編集した植物のシークエンスの解析」を参照