シロイヌナズナの遺伝子型の判定
提供: 鈴木研Wiki
(版間での差分)
(→プライマーと制限酵素の組合せ) |
|||
| (3人の利用者による、間の38版が非表示) | |||
| 1行: | 1行: | ||
__NOTOC__ | __NOTOC__ | ||
| + | 2023年8月に改正。 改正前のページ → [[シロイヌナズナの遺伝子型の判定(2023年8月以前のver.)]] | ||
| − | == 試薬 == | + | == (1) DNA抽出 (マルチビーズショッカー) == |
| + | ==== 試薬 ==== | ||
* 0.4M NaOH | * 0.4M NaOH | ||
* 0.1M Tris-HCl pH 6.8 | * 0.1M Tris-HCl pH 6.8 | ||
| − | == | + | ==== 手順 ==== |
| − | # | + | # 葉を一枚切り取り、サンプル破砕用チューブに入れる |
| − | + | ||
# ビーズを一粒入れる | # ビーズを一粒入れる | ||
| + | # 40 µlの0.4M NaOHを入れる | ||
# 2000rpmで5秒オン、2秒オフのサイクルを2回行う | # 2000rpmで5秒オン、2秒オフのサイクルを2回行う | ||
# 遠心(フラッシュ) | # 遠心(フラッシュ) | ||
| 15行: | 17行: | ||
# 上清を鋳型として用いる | # 上清を鋳型として用いる | ||
| − | == PCR == | + | == (2) PCR == |
| − | === | + | <table border="0"><tr> |
| + | |||
| + | <td> | ||
| + | ==== MightyAmp Ver.3 の場合 ==== | ||
{| class='wikitable' | {| class='wikitable' | ||
| − | | | + | |+ '''反応液の組成''' |
| + | ! 試薬 !! 1サンプル分の量 !! 備考 | ||
|- | |- | ||
| − | | | + | |MightyAmp Ver3||style="text-align:right;"| 0.4 µl || |
|- | |- | ||
| − | | | + | |2×MightyAmp buffer Ver3 ||style="text-align:right;"| 10 µl || |
| + | |- | ||
| + | |プライマー (Forward)||style="text-align:right;"| 終濃度0.3 µM || 10µMの場合、0.6 µl | ||
|- | |- | ||
| − | | | + | |プライマー (Reverse)||style="text-align:right;"| 終濃度0.3 µM || 10µMの場合、0.6 µl |
|- | |- | ||
| − | | | + | |DNA||style="text-align:right;"| 1 µl || |
|- | |- | ||
| − | | | + | |滅菌水||style="text-align:right;"| up to 20 µl || |
|- | |- | ||
| − | |合計||20 µl | + | |合計||style="text-align:right;"| 20 µl || |
|} | |} | ||
| − | === | + | '''反応''' |
| − | # 95℃ 3分 | + | * '''2step PCR''' |
| − | # 95℃ | + | # 98℃ 2分 |
| − | # 72℃ 5分 | + | # [98℃ 10秒、(アニーリング + 伸長反応)68℃ 1分] のサイクルを35回 |
| + | # (→ 4℃ ∞) | ||
| + | |||
| + | |||
| + | * '''3step PCR''' | ||
| + | # 98℃ 2分 | ||
| + | # [98℃ 10秒、(アニーリング)60℃ 15秒、(伸長反応)68℃ 1分] のサイクルを35回 | ||
| + | # (→ 4℃ ∞) | ||
| + | |||
| + | </td> | ||
| + | |||
| + | <td> | ||
| + | |||
| + | ==== Ex Taq の場合 ==== | ||
| + | {| class='wikitable' | ||
| + | |+ '''反応液の組成''' | ||
| + | ! 試薬 !! 1サンプル分の量 !! 備考 | ||
| + | |- | ||
| + | |ExTaq||style="text-align:right;"| 0.1 µl || | ||
| + | |- | ||
| + | |10×ExTaq Buffer||style="text-align:right;"| 2 µl || | ||
| + | |- | ||
| + | |2.5mM dNTP||style="text-align:right;"| 1.6 µl || | ||
| + | |- | ||
| + | |プライマー (Forward)||style="text-align:right;"| 終濃度 0.2 µM || 10µMの場合、0.4 µl | ||
| + | |- | ||
| + | |プライマー (Reverse)||style="text-align:right;"| 終濃度 0.2 µM || 10µMの場合、0.4 µl | ||
| + | |- | ||
| + | |DNA||style="text-align:right;"| 1 µl || | ||
| + | |- | ||
| + | |滅菌水||style="text-align:right;"| up to 20 µl || | ||
| + | |- | ||
| + | |合計||style="text-align:right;"| 20 µl || | ||
| + | |} | ||
| + | |||
| + | '''反応''' | ||
| + | # 95℃ 3分 | ||
| + | # [95℃ 45秒、(アニーリング)55℃ 45秒、(伸長反応)72℃ 2分] のサイクルを35回 | ||
| + | # 72℃ 5分 (→ 4℃ ∞) | ||
| + | |||
| + | <br><br><br> | ||
| + | <!-- <table>タグで2段組にすると上下中央揃いになるため、改行タグ<br>で位置合わせした --> | ||
| + | </td> | ||
| + | |||
| + | </tr> | ||
| + | </table> | ||
| + | |||
| + | == (3) 制限酵素処理 == | ||
| + | <table border="0"> | ||
| + | <tr> | ||
| + | |||
| + | <td> | ||
| + | {| class='wikitable' | ||
| + | |+ '''反応液の組成''' | ||
| + | |||1サンプル | ||
| + | |- | ||
| + | |滅菌水||style="text-align:right;"| 5.7 µl | ||
| + | |- | ||
| + | |10x Buffer||style="text-align:right;"|1 µl | ||
| + | |- | ||
| + | |制限酵素||style="text-align:right;"|0.3 µl | ||
| + | |- | ||
| + | |PCR産物(上記参照)||style="text-align:right;"|3 µl | ||
| + | |- | ||
| + | |合計||style="text-align:right;"|10 µl | ||
| + | |} | ||
| + | </td> | ||
| + | |||
| + | <td> | ||
| + | '''反応''' | ||
| + | <br> → 37℃で1~2時間反応 | ||
| + | </td> | ||
| + | |||
| + | </tr> | ||
| + | </table> | ||
| + | |||
| + | == (4) 解析 == | ||
| + | MultiNA(あるいは、アガロースゲル)で電気泳動し、バンドの長さを判別 | ||
| + | |||
| + | |||
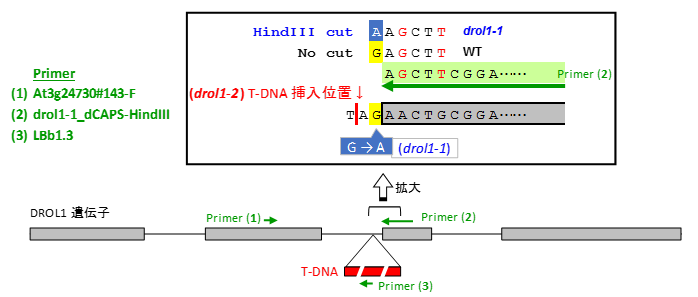
| + | == < 各drol1変異体の変異箇所とプライマーの結合部位 > == | ||
| + | <table border="0"> | ||
| + | <tr> | ||
| + | |||
| + | <td> | ||
| + | [[ファイル:drol1_genotyping.png]] | ||
| + | </td> | ||
| + | |||
| + | <td> | ||
| + | *'''WT (DROL1)''' | ||
| + | **PCR:プライマー(1)+(2)で増幅(185bp) | ||
| + | **HindIII処理後(185bpのまま) | ||
| + | |||
| + | *'''drol1-1''' | ||
| + | **PCRプライマー:(1)+(2)で増幅(185bp) | ||
| + | **HindIII処理後(152+33bp) | ||
| + | |||
| + | *'''drol1-2''' | ||
| + | **PCRプライマー:(1)+(3)で増幅(≒355bp) | ||
| + | **HindIII処理後(≒355bpのまま) | ||
| + | </td> | ||
| + | |||
| + | </tr> | ||
| + | </table> | ||
| + | |||
| + | == < drol1変異体と各sudl変異体の遺伝子マーカー > == | ||
| + | ==== プライマーと制限酵素の組合せ ==== | ||
| + | {| class="wikitable" style="width:100%" | ||
| + | ! 変異体 !! 遺伝子名 !! PCRのプライマー !! プライマー配列 !! PCR断片長 !! 制限酵素 !! 制限酵素処理後の長さ | ||
| + | |- | ||
| + | ! drol1-1 <br> | ||
| + | | DROL1|| At3g24730#143-F <br> drol1-1_dCAPS-HindIII|| TGATATCACGTTGTTTCCTTCG <br> GAAATGCACCAACCCATTTAGTATGATCCGAAGCT|| 185 bp|| HindIII|| (WT) 185 bp <br> (drol1-1) 152+33 bp | ||
| + | |- | ||
| + | ! drol1-2 <br> | ||
| + | | DROL1|| At3g24730#143-F <br> drol1-1_dCAPS-HindIII <br> LBb1.3 || TGATATCACGTTGTTTCCTTCG <br> GAAATGCACCAACCCATTTAGTATGATCCGAAGCT <br> ATTTTGCCGATTTCGGAAC || (WT)185 bp <br> (drol1-2)≒355 bp|| - || - | ||
| + | |- | ||
| + | ! sudl1-1 <br> #8-5 | ||
| + | | U5-40k|| m2g181F <br> m2g181R|| CAAGATACAATCACAGGTATGAGC <br> CACAGCTTTGAAATTCAGATCTCTC|| 383 bp|| HaeIII|| (WT) 272+111 bp <br> (#8-5) 383 bp | ||
| + | |- | ||
| + | ! sudl2-1 <br> #47-1a | ||
| + | | PRP6|| prp6_47-1aF <br> prp6_47-1aR|| GCTGAGGAGAAAAGGTACGATGAGA <br> CCTCTGATCAATAGACTCCCAGATGGCATCAAGCT|| 135 bp|| HindIII|| (WT) 135 bp <br> (#47-1a) 102+33 bp | ||
| + | |- | ||
| + | ! sudl2-2 <br> #45-4b | ||
| + | | PRP6|| prp6_45-4bR <br> prp6_45-4bF|| GGAGATGGCTTGCCATTTCTCGCCATGCTTAAGCT<br> GAACGTGCTGTTACCGTTGG|| 155 bp|| HindIII|| (WT) 155 bp <br> (#45-4b) 120+35 bp | ||
| + | |- | ||
| + | ! sudl3-1 <br> #14-4 | ||
| + | | PRP8|| prp8_14-4F <br> prp8_14-4R|| CAACCCGCAGAAAAGCTACTGCAGTCCTCTCGATC <br> AGTGACTCTTTTGCATCTTGCTTG|| 161 bp|| PvuI|| (WT) 128+33 bp <br> (#14-4) 161 bp | ||
| + | |- | ||
| + | ! sudl3-2 <br> #49-4a | ||
| + | | PRP8|| prp8_49-4aF <br> prp8_49-4aR|| ATTCATACTTTATTAATTATAGACATTGAGCCACG <br> ATTCTTGGCGGACACATAGTCTGCAATATTGAGCT|| 130 bp|| SacI|| (WT) 97+33 bp <br> (#49-4a) 130 bp | ||
| + | |- | ||
| + | ! sudl3-3 <br> #51-2a | ||
| + | | PRP8|| prp8_51-2aF <br> prp8_51-2aR|| ACCTGAAAGATGGTCCGTATGTCACTCCAGACTAA <br> CTTTGTGTCATGTTTGTATGACAATGGAGGGAATG|| 131 bp|| DdeI|| (WT) 97+34 bp <br> (#51-2a) 131 bp | ||
| + | |- | ||
| + | ! sudl4-1 <br> #40-2b | ||
| + | | SmBb|| smbb_40-2bF <br> smbb_40-2bR|| GCTTCAGTTCATCAACTACAGG <br> CTTCTTCCCTTTAGCTGGTGGTAGCTTACGAAGCT|| 148 bp|| HindIII|| (WT) 148 bp <br> (#40-2b) 113+35 bp | ||
| + | |- | ||
| + | ! sudl4-2 <br> #43-2b | ||
| + | | SmBb|| smbb_43-2bF <br> smbb_43-2bR|| TCGTGCTAAAGCTGGCTCTGCAGCTGCTGTTGCGG <br> TCCACCAACACCACGAACAGGAC|| 133 bp|| BamHI|| (WT) 133 bp <br> (#43-2b) 97+36 bp | ||
| + | |- | ||
| + | |} | ||
2024年4月9日 (火) 15:00時点における最新版
2023年8月に改正。 改正前のページ → シロイヌナズナの遺伝子型の判定(2023年8月以前のver.)
[編集] (1) DNA抽出 (マルチビーズショッカー)
[編集] 試薬
- 0.4M NaOH
- 0.1M Tris-HCl pH 6.8
[編集] 手順
- 葉を一枚切り取り、サンプル破砕用チューブに入れる
- ビーズを一粒入れる
- 40 µlの0.4M NaOHを入れる
- 2000rpmで5秒オン、2秒オフのサイクルを2回行う
- 遠心(フラッシュ)
- 200 µlの0.1M Tris-HClを加える
- よく混合し、遠心(フラッシュ)
- 上清を鋳型として用いる
[編集] (2) PCR
[編集] MightyAmp Ver.3 の場合
反応
|
[編集] Ex Taq の場合
反応
|
[編集] (3) 制限酵素処理
|
反応
|
[編集] (4) 解析
MultiNA(あるいは、アガロースゲル)で電気泳動し、バンドの長さを判別
[編集] < 各drol1変異体の変異箇所とプライマーの結合部位 >
|
[編集] < drol1変異体と各sudl変異体の遺伝子マーカー >
[編集] プライマーと制限酵素の組合せ
| 変異体 | 遺伝子名 | PCRのプライマー | プライマー配列 | PCR断片長 | 制限酵素 | 制限酵素処理後の長さ |
|---|---|---|---|---|---|---|
| drol1-1 |
DROL1 | At3g24730#143-F drol1-1_dCAPS-HindIII |
TGATATCACGTTGTTTCCTTCG GAAATGCACCAACCCATTTAGTATGATCCGAAGCT |
185 bp | HindIII | (WT) 185 bp (drol1-1) 152+33 bp |
| drol1-2 |
DROL1 | At3g24730#143-F drol1-1_dCAPS-HindIII LBb1.3 |
TGATATCACGTTGTTTCCTTCG GAAATGCACCAACCCATTTAGTATGATCCGAAGCT ATTTTGCCGATTTCGGAAC |
(WT)185 bp (drol1-2)≒355 bp |
- | - |
| sudl1-1 #8-5 |
U5-40k | m2g181F m2g181R |
CAAGATACAATCACAGGTATGAGC CACAGCTTTGAAATTCAGATCTCTC |
383 bp | HaeIII | (WT) 272+111 bp (#8-5) 383 bp |
| sudl2-1 #47-1a |
PRP6 | prp6_47-1aF prp6_47-1aR |
GCTGAGGAGAAAAGGTACGATGAGA CCTCTGATCAATAGACTCCCAGATGGCATCAAGCT |
135 bp | HindIII | (WT) 135 bp (#47-1a) 102+33 bp |
| sudl2-2 #45-4b |
PRP6 | prp6_45-4bR prp6_45-4bF |
GGAGATGGCTTGCCATTTCTCGCCATGCTTAAGCT GAACGTGCTGTTACCGTTGG |
155 bp | HindIII | (WT) 155 bp (#45-4b) 120+35 bp |
| sudl3-1 #14-4 |
PRP8 | prp8_14-4F prp8_14-4R |
CAACCCGCAGAAAAGCTACTGCAGTCCTCTCGATC AGTGACTCTTTTGCATCTTGCTTG |
161 bp | PvuI | (WT) 128+33 bp (#14-4) 161 bp |
| sudl3-2 #49-4a |
PRP8 | prp8_49-4aF prp8_49-4aR |
ATTCATACTTTATTAATTATAGACATTGAGCCACG ATTCTTGGCGGACACATAGTCTGCAATATTGAGCT |
130 bp | SacI | (WT) 97+33 bp (#49-4a) 130 bp |
| sudl3-3 #51-2a |
PRP8 | prp8_51-2aF prp8_51-2aR |
ACCTGAAAGATGGTCCGTATGTCACTCCAGACTAA CTTTGTGTCATGTTTGTATGACAATGGAGGGAATG |
131 bp | DdeI | (WT) 97+34 bp (#51-2a) 131 bp |
| sudl4-1 #40-2b |
SmBb | smbb_40-2bF smbb_40-2bR |
GCTTCAGTTCATCAACTACAGG CTTCTTCCCTTTAGCTGGTGGTAGCTTACGAAGCT |
148 bp | HindIII | (WT) 148 bp (#40-2b) 113+35 bp |
| sudl4-2 #43-2b |
SmBb | smbb_43-2bF smbb_43-2bR |
TCGTGCTAAAGCTGGCTCTGCAGCTGCTGTTGCGG TCCACCAACACCACGAACAGGAC |
133 bp | BamHI | (WT) 133 bp (#43-2b) 97+36 bp |